

Влияние радиоактивного излучения на показатели периферической крови ликвидаторов аварии на Чернобыльской АЭС
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ
1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Природа и виды ионизирующих излучений, единицы измерения
1.2. Действие ионизирующих излучений на организм
1.2.1. Воздействие на клетку
1.2.2. Воздействие на организм в целом
1.2.3. Изменения в системе крови
1.3. Возрастные изменения в организме
2. МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
3.1. Изменения параметров крови в зависимости от возраста
3.2. Динамика показателей периферической крови
3.3. Изменения состава крови в зависимости от дозы
ВЫВОДЫ
ЛИТЕРАТУРА
Приложение
ВВЕДЕНИЕ
Широкое распространение ядерных технологий влечет за собой неизбежное расширение круга людей, подвергающихся воздействию ионизирующего изучения. Это рабочие урановых рудников и предприятий по переработке урановых руд, радиоактивных отходов, врачи-рентгенологи и радиологи, персонал АЭС, экипажи ядерных подводных лодок и кораблей, гамма-дефектоскописты.
Радиационные катастрофы приводят к облучению большого количества людей, загрязняется окружающая среда. В результате чернобыльской катастрофы пострадали значительные территории, на которых сейчас проживает сотни тысяч человек.
В первые месяцы после чернобыльской катастрофы от острой лучевой болезни погибло 30 человек. Но эти жертвы были лишь первыми. Спустя год-два у людей начали появляться вегето-сосудистые расстройства, различные поражения желудочно-кишечного тракта, расстройства иммунной и нервной систем. К началу 1998 г из 350 тысяч ликвидаторов умерло около 12500.
Влияние ионизирующих излучений на организм представляет большой интерес для науки и практической медицины. Значительное количество работ направлено на изучение изменений системы крови в результате радиационных воздействий. Многочисленные исследования посвящены влиянию радиации на кроветворение в ближайшие сроки воздействия [27,33,44 и др.], а также в отдаленном периоде [9,19,37,58 и др.]. Влияние ионизирующего излучения на показатели периферической крови в ближайший период после облучения изучено достаточно хорошо, слабее изучена динамика показателей крови в отдаленном периоде постлучевого восстановления. Кроме того, в то время как множество исследований посвящено влиянию излучения большой интенсивности [15,18,58 и др.], влиянию малых доз излучения на организм должное внимание уделяется лишь в последнее время [20,61].
В настоящей работе представлены результаты изучения динамики клинических показателей крови человека на протяжении 12 лет с момента аварии, сделана попытка установить зависимость влияния облучения от возраста и полученной дозы.
Исследования проводились в клинико-биохимической лаборатории Донецкой областной клинической больницы профзаболеваний.
1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Природа и виды ионизирующих излучений, единицы измерения.
Ионизирующие излучения получили свое название благодаря способности вызывать ионизацию атомов и молекул в облучаемом веществе. Энергия кванта излучения, взаимодействуя с веществом, приводит к переходу атома или молекулы в возбужденное состояние вплоть до высвобождения электрона. Для ионизации большинства биомолекул необходимо достаточно большое количество энергии – 10-15 эВ (1 эВ = 1,6*10 12 эрг), называемое потенциалом ионизации [62].
По природе ионизирующие излучения бывают корпускулярными и электромагнитными. К электромагнитным относятся коротковолновые излучения (например, СВЧ), рентгеновское, гамма-излучение, электромагнитные волны оптического диапазона (например, лазерное) и тормозное излучение, возникающее при прохождении через вещество сильно ускоренных заряженных частиц (получают искусственно в синхрофазотронах).
Применительно к ситуации вокруг аварии на ЧАЭС наибольший интерес представляют лишь два вида излучений из вышеперечисленных: рентгеновское излучение с длиной волны 10 -14 -10 -7 м, испускаемое при торможении быстрых электронов в веществе и при переходах электронов с внешних электронных оболочек атома на внутренние, и гамма-излучение с длиной волны менее 10 -10 м, возникающее при распаде радиоактивных ядер и элементарных частиц, при взаимодействии быстрых заряженных частиц с веществом, при аннигиляции (взаимном уничтожении с высвобождением фотона) электронно-позитронных пар. Т.о., волновые характеристики этих излучений сходны, они перекрываются в диапазоне 10 -14 -10 -10 м.
При взаимодействии электромагнитных излучений с веществом наблюдаются следующие эффекты:
Фотоэлектрический : характерен для длинноволнового рентгеновского излучения; сущность эффекта состоит в том, что высвободившийся электрон реагирует с нейтральным атомом с образованием аниона.
Эффект Комптона : происходит рассеяние энергии падающего фотона; электрон получает лишь часть энергии, образуется быстрый электрон и вторичный фотон.
Образование электронно-позитронных пар : этот процесс обусловлен столкновением гамма-кванта с какой-либо заряженной частицей.
Из корпускулярных излучений наиболее распространены бета-частицы (электроны), протоны, дейтроны (ядра дейтерия), альфа-частицы (ядра гелия), тяжелые ионы, нейтроны, пи-мезоны.
Для всех заряженных частиц механизм передачи энергии атому один и тот же. При прохождении через вещество заряженная частица теряет свою энергию, вызывая ионизацию и возбуждение атомов, пока не исчерпается запас ее энергии. Чем больше масса летящей частицы, тем меньше она отклоняется от первоначального направления. Полет протонов практически прямолинеен, а траектория электрона сильно изломана вследствие рассеяния на орбитальных электронах и в результате притяжения ядрами атомов (упругое многократное рассеяние). Неупругое торможение имеет место при прохождении электрона вблизи ядра. Скорость его падает, часть энергии теряется, испускаются фотоны тормозного излучения, т.е. образуется электромагнитное излучение.
Нейтроны обладают высокой проникающей способностью. При упругом рассеянии на ядрах С, N, О и других элементов, входящих в состав живой ткани, нейтрон теряет лишь 10-15% энергии, а при столкновении с ядром водорода энергия нейтрона снижается вдвое [34].
При нейтронном облучении конечный биологический эффект связан с ионизацией, производимой опосредованно вторичными частицами или фотонами.
Характеристики различных единиц радиоактивности приведены в таблице 1.1.
Таблица 1.1.
Единицы измерения радиоактивности.
|
Физическая величина |
Единица |
Соотношение между единицами |
||
|
система СИ |
внесистемная |
СИ-внесистемная |
Внесистемная-СИ |
|
|
Экспозиционная доза |
Кл/кг |
Р, рентген |
1 Кл/кг = 3876 Р |
1 Р = 2,58*10 -4 Кл/кг |
|
Коэффициент погло- щения излучения |
Гр, грей |
рад |
1 Гр = 100 рад |
1 рад = 0,01 Гр |
|
Активность изотопа |
Ки, кюри |
Бк, беккерель |
1 Ки = 3,7*10 10 Бк |
1 Бк = 2,7*10 -11 Ки |
|
Мощность поглощен- ной дозы (интенсив-ность облучения) |
Гр/с |
Рад/с |
1 Гр/с = 100 рад/с |
1 рад/с = 0,01 Гр/с |
|
Мощность экспозиционной дозы |
А/кг |
Р/с |
1 А/кг = 3876 Р/с |
1 Р/с = 2,58*10 -4 А/кг |
|
Эквивалентная доза |
Зв, Зиверт |
Бэр |
1 Зв = 100 бэр |
1 бэр = 0,01 Зв |
Рассмотрим физический смысл приведенных в таблице величин.
Экспозиционная доза. Отражает количество падающей на объект энергии излучения за время облучения. Вычисляется по формуле:
![]()
где dQ – полный заряд ионов одного знака, возникающих в воздухе при полном торможении всех вторичных электронов, образованных фотонами в малом объеме воздуха; dM – масса воздуха в этом объеме.
2. Коэффициент поглощения излучения. Вычисляется по формуле:
![]()
где dE – средняя энергия, переданная излучением веществу в некотором элементарном объеме, dm – масса вещества в этом объеме. 1 Гр = 100 рад.
3. Активность изотопа. 1 Беккерель соответствует 1 ядерному превращению в секунду.
4. Мощность поглощенной дозы . Используется для характеристики распределения поглощенной дозы во времени. Отражает количество энергии излучения, поглощаемое в единицу времени единицей массы вещества.
5. Эквивалентная доза . В какой-либо точке ткани определяется уравнением:
Н = ДQN,
где Д – поглощенная доза, Q и N – модифицирующие факторы. Q показывает, во сколько раз ожидаемый для данного вида излучения биологический эффект больше, чем действие рентгеновского излучения мощностью 250 кЭВ. Для гамма- и бета-излучения Q = 1, для альфа-излучения он равен 20. N – произведение всех других модифицирующих факторов. Т.е., если внешнее излучение составляет 3 Р/ч, то человек находившийся под этим воздействием получит за этот час суммарную дозу 3 бэра , если излучаются гамма- и бета-частицы, и 60 бэр, если излучаются альфа-частицы.
1.2. Действие ионизирующих излучений на организм.
1.2.1. Воздействие на клетку.
Радиочувствительность клетки прямо пропорциональна ее митотической активности и обратно пропорциональна степени ее дифференциации [34]. Наиболее чувствительными оказываются ткани с интенсивным делением: эпителиальная, кровь. Наиболее радиорезистентными являются ткани, утратившие способность к делению: мышечная, нервная, костная и хрящевая ткани. Есть и исключения, например, малые лимфоциты – клетки неделящиеся, но гибнет в митозе при дозе 1 Гр 63% от их количества [60].
В клетке радиация может вызвать два вида изменений: клеточных структур и генетического материала (генные мутации и хромосомные аберрации). Соответственно выделяют два вида радиационной гибели клеток: интерфазная (до вступления клеток в митоз) и митотическая. В первом случае предполагают, что смерть наступает в результате окисления липидов клетки и образования радиотоксинов, которые вызывают иммунные реакции, склеивание клеток и их разрушение, а также торможение клеточного деления и повреждения хромосомного аппарата. Во втором случае наступает либо гибель потомков мутантных клеток вследствие их нежизнеспособности, либо невозможности расхождения хромосом в анафазу вследствие изменений структуры ДНК клеток [34]. Какое поколение потомков таких клеток погибнет, зависит от значимости потерянного генетического материала. Выживаемость клеток зависит также от эффективности системы репарации, которая снижается, если повреждается в результате облучения. К тому же поврежденный ген может быть недоступен для восстановления, находясь в неактивном состоянии. 7,4% жителей загрязненных территорий и 3,4% ликвидаторов имеют хромосомные аберрации [23].
Цитоплазма клеток намного менее чувствительна к радиации, чем ядро. Гибель зародыша яйца наездника индуцируется облучением ядра одной альфа-частицей, цитоплазмы – 15 млн альфа-частиц [62]. Для большинства клеток животных интерфазная гибель наступает только при дозах более 10 Гр [62].
Однако мутации могут быть не смертельными для клетки, в этом случае пораженные клетки увеличивают риск появления ракового заболевания. Наиболее частыми являются лейкозы, возникающие только спустя 2 года после облучения и позже. Через 6-7 лет вероятность заболеть лейкозом наиболее велика, а спустя 25 лет риск заболеть лейкозом практически равен нулю. Другие виды рака могут развиваться только через 10 лет после облучения [52].
Для всех клеток организма механизм воздействия радиации одинаков, он заключается в повреждении клетки прямым или косвенным образом. Прямое воздействие заключается в изменении структуры молекул, косвенное осуществляется через механизм радиолиза воды. В результате получаются ионы водорода и гидроксильные группы, которые мгновенно реагируют с веществами клетки. В присутствии кислорода образуются и другие продукты радиолиза, обладающие окислительными свойствами:
Н· + О 2 = НО 2·
НО 2· + НО 2· = Н 2 О 2 + 2О
Следует также принимать во внимание наличие модифицирующих факторов – сенсибилизаторов (веществ, увеличивающих эффект излучения) и радиопротекторов. Повышенное содержание кислорода в клетках во время облучения усиливает действие излучения, что объясняется усилением взаимодействия кислорода со свободными радикалами клетки и делает их недоступными для репарации. Однако присутствие кислорода в среде после облучения способствует репарации повреждений [62]. Сниженное содержание кислорода во время облучения способствует уменьшению его пагубного воздействия на организм [10]. Известно много радиопротекторов, но они проявляют свое действие только в момент облучения и в ближайшие сроки после него.
1.2.2. Воздействие на организм в целом.
Радиочувствительность организма зависит от многих факторов. Чем больше степень организации животного, чем более дифференцированы его ткани, тем больше оно чувствительно к радиации. Например, среднелетальная доза (ЛД 50 ), отражающая дозу внешнего излучения, накопленную за короткий промежуток времени, при которой погибают 50% облученных особей, для человека равна 4,5 Гр, для обезьяны – 5,2 Гр, для черепахи – 15 Гр, для дрозофилы – 800 Гр, для простейших – 1000 Гр и более [4]. Известны также некоторые виды бактерий, которые выживают при дозах более 10000 Гр (найдены в пруде-охладителе Чернобыльской АЭС). Для оценки радиочувствительности используется также величина, называемая минимальной абсолютно смертельной дозой (ЛД 100 ): это та минимальная доза, при которой умирают все особи.
Радиация вызывает различного рода неблагоприятные изменения в организме человека. К ближайшим последствиям относят острую лучевую болезнь (ОЛБ) и хроническую лучевую болезнь (ХЛБ), к отдаленным - злокачественные опухоли, лучевую катаракту, снижение продолжительности жизни, атеросклероз и другие явления, являющиеся признаками старения организма. ОЛБ возникает при дозах более 2 Гр, полученных одномоментно или в течение нескольких дней, ХЛБ – при облучении малыми дозами 0,1 - 0,5 сГр/сут после накопления суммарной дозы 0,7 - 1 Гр, т.е. через 140 - 1000 дней [62].
Дозы до 1 Гр характеризуются отсутствием признаков лучевой болезни, отмечаются лишь преходящие реакции со стороны отдельных систем, при 1 - 2,5 Гр примерно половина людей заболевают ОЛБ. При дозах до 3 Гр выздоравливают без медицинской помощи все заболевшие, свыше 3 Гр – заболевают все, без медицинской помощи выздороветь не могут. 6 Гр – минимальная абсолютно смертельная доза [4], приводящая к смерти из-за поражений костного мозга (из 100 стволовых клеток умирают 99), хотя в литературе отмечены отдельные случаи выживания при дозах от 6 до 10 Гр, характеризующиеся выраженным повреждением кишечника [62]. При 10 - 20 Гр смерть наступает через 8-16 дней от поражения слизистой желудочно-кишечного тракта, при 20 - 80 Гр развивается сосудистая форма поражения, смерть наступает через 4-7 дней при мозговой и менингиальной симптоматике. При дозах более 80 Гр летальный исход наступает через 1-3 дня от поражений ЦНС (церебральный синдром), сопровождающихся коллапсом и судорогами [52].
Кроме трех основных точек приложения, радиация специфически действует на другие органы.
Известно пагубное влияние радиации на детородную функцию. Однократное облучение семенников в дозах 0,1 - 0,2 Гр приводит к временной стерильности с последующим полным восстановлением, дозы от 2 Гр и выше приводят к почти полной стерильности, восстановление функции наступает только через несколько лет. Семенники значительно лучше выдерживают разовое облучение, чем пролонгированное. Однократное облучение в дозе более 3 Гр приводит к необратимой стерильности яичников, меньшие дозы не вызывают никаких изменений. Большие дозы, растянутые во времени, также не влияют на детородную функцию женщины [52].
Реакции на облучение со стороны сердечно-сосудистой системы характеризуются изменениями наружного слоя сосудистой стенки за счет перерождения коллагена. Наблюдаются изменения миокарда после локального облучения в дозах 5 - 10 Гр, миокардиофиброз (от 4,5 Гр) – нарушение микроциркуляции вследствие облитерации (слипания стенок) капилляров, эритема.
Тяжелые поражения центральной нервной системы при дозах от 10 Гр проявляются в отдаленные сроки после облучения. При дозах 0,1 - 1 Гр изменяются биотоки мозга, условно-рефлекторная деятельность, облучение мозга детей приводит к слабоумию. При местном облучении участка тела в области периферического нерва возникают парезы конечностей, что связывают с повреждением окружающих нерв сосудов и нарушением его питания. Воздействии узкого пучка излучения непосредственно на нерв не вызывает изменений его структуры и функций.
Действие излучения на зрение выражается в конъюнктивитах (от 5 Гр) и катаракте, возникающей при дозах более 6 Гр. Максимально переносимая кожей доза местного рентгеновского излучения – 10 Гр, при больших интенсивностях возникают дерматиты и язвы. Облучение обеих почек в дозах более 30 Гр за 5 недель может вызвать необратимый хронический нефрит. Действие излучения на скелет выражается в замедлении заживления переломов. Малые дозы облучения (10 Гр за несколько недель) хрящевой ткани детей могут остановить рост костей [62].
На сегодняшний день существует три гипотезы насчет влияния излучения на организм в зависимости от дозы. Первая предполагает, что степень поражения находится в прямой зависимости от дозы излучения, радиация вредна в сколь угодно малых дозах. Это оправдывается тем, что один нейтрон способен вызвать генную мутацию [62]. Вторая предполагает наличие порога, ниже которого воздействие радиации бесполезно для организма.
Третья гипотеза основывается на предположении об усиливающем эффекте малых доз облучения. В пользу этой гипотезы говорят исследования некоторых авторов, обнаруживших усиливающее действие радиации на организм животных (до 25 Р) [33], ускорение прорастания семян и роста растений (до 500 Р) [39], увеличение продолжительности жизни мышей и крыс в условиях крайне низкого хронического облучения. Для тканей и органов человека эта доза приблизительно равна 2 Р [61]. Авторы рассматривают радиацию как фактор, стимулирующий защитно-приспособительные реакции организма [20,50,58,61]. Однако в отдаленном периоде постлучевого восстановления наблюдается срыв компенсаторных возможностей и ухудшение состояния организма [50,58]. По-видимому, лишь небольшое превышение доз над естественным радиоактивным фоном положительно влияет на организм.
Последствия облучения зависят не только от дозы, но и от вида облучения – общее оно или местное, внешнее или от инкорпорированных радионуклидов; от временного фактора (однократное, повторное, пролонгированное, хроническое); от равномерности облучения, величины облучаемого объема и локализации облученного участка, от соотношения радиопротекторов и сенсибилизаторов в организме. Значительное снижение воздействия излучений на организм наблюдается при экранировании участков костного мозга [28,46].
1.2.3. Изменения в системе крови.
Существуют общие закономерности в изменениях качественного и количественного состава периферической крови под воздействием радиации. Снижение количества форменных элементов наступает тем раньше и интенсивней, чем больше доза облучения.
Из-за высокой чувствительности клеток костного мозга, связанной с их интенсивным делением и дифференциацией, наблюдаются сильные изменения в периферической крови под воздействием радиации. Сравнительно небольшие дозы в 2 - 10 Гр вызывают гибель клеток костного мозга непосредственно в момент облучения или в митозах, при этом клетки теряют способность к делению. Генные перестройки в них в виде генных мутаций и хромосомных аберраций часто не мешают делению клетки. Элиминация мутантных клеток происходит медленнее, чем образование новых клеток, поэтому всегда имеется риск образования опухолей, особенно лейкозов [52].
В костном мозге обнаруживаются следующие изменения: аплазия, фиброз [47], жировое его перерождение с островками кроветворной ткани, состоящей из зрелых гранулоцитов [12], через 6 месяцев после облучения обнаруживаются скопления ретикулярных клеток [12,47]. Гипоплазия и аплазия костного мозга наблюдается в течение первых суток после облучения, что связано с массовой гибелью клеток. Нарушения выявляются сначала в гранулоцитопоэзе, затем в тромбоцитопоэзе, значительно позднее - в эритропоэзе [45].
Наблюдается обеднение костного мозга ранними предшественниками кроветворения, т.к. эти клетки - малодифференцированные, интенсивно делящиеся, а следовательно и радиочувствительные. Поздние предшественники клеток периферической крови менее радиочувствительны, кроме предшественников лейкоцитов и эритроцитов [62]. Из-за резкого сокращения пула предшественников продукция зрелых форм в костном мозге временно снижается. Падение числа форменных элементов крови сопровождается включением компенсаторных механизмов, выражающихся в ускорении созревания клеток в костном мозге [15,17], уменьшении их жизнеспособности. Наблюдается относительное увеличение эритробластического ростка [36].
В ближайший период после лучевого воздействия наблюдается падение числа всех форменных элементов крови.
Число циркулирующих эритроцитов по данным одних авторов, уменьшается [8,14, 27,37,43], другие исследователи приводят противоположные данные: в промежутке доз от 5 до 25 Р в крови крыс обнаруживается увеличение числа эритроцитов [33]. Это явление увеличения показателей при облучении в малых дозах оправдано недавними исследованиями и получило название гормезиса [20,61]. Предположительно, эффект усиления вызван стимуляцией центров нейро-эндокринной регуляции.
Ряд исследователей отмечают снижение количества ретикулоцитов [9,27,38,47], что связано с укорочением их циркуляции и преобразованием в зрелый эритроцит [27]. Увеличения количества эритроцитов не происходит, так как значительно снижается продолжительность их жизни (до 43 дней) [3,16,56].
При визуальном исследовании мазков крови отмечалось снижение числа дискоцитов (нормальных эритроцитов) и увеличение содержания стоматоцитов, сфероцитов и шизоцитов. В целом количество аномальных форм эритроцитов через 5 лет после лучевой нагрузки достигало у ликвидаторов 25-30% [35]. Эритроциты полихроматофильны [37], увеличивается их средний диаметр [14], средний объем и амплитуда анизоцитоза [16]. Снижается кислотная стойкость эритроцитов [16], чем объясняется снижение времени их циркуляции.
Снижается способность костного мозга к синтезу гемоглобина [36]. Со снижением числа эритроцитов закономерно падает и концентрация гемоглобина в периферической крови [30,37,43]. Относительное содержание гемоглобина в одном эритроците увеличивается [43], увеличивается цветовой показатель [30]. Изменяется количественный аминокислотный состав гемоглобина, ослабляется прочность связи между гемом и глобином, повышается процент метгемоглобина [55]. Снижением количества гемоглобина после радиационного воздействия объясняется снижение кислородной емкости крови [43], при этом в 2-3 раза возрастает способность гемоглобина к включению соединений [22].
Снижается содержание общего железа в плазме крови [40,43] вследствие снижения числа эритроцитов. Увеличивается скорость включения железа в эритроциты [3] и железо-
связывающая способность плазмы [40]. Снижается концентрация сывороточного ферритина, необходимого для синтеза гема [40].
Регуляция эритропоэза осуществляется гормоном гликопротеиновой природы эритропоэтином. Он действует на клетки-предшественники эритроцитов, а также увеличивает скорость образования гемоглобина. Высокие дозы облучения вызывали обогащение крови эритропоэтинтормозящими веществами, хроническое облучение в малых дозах не вызывало каких-либо изменений в содержании эритропоэтинов [29].
Увеличение количества СОЭ отмечено многими исследователями [8,16]. Это может быть следствием снижения числа эритроцитов, снижения отрицательного заряда мембраны в сторону более положительного. При снижении количества ретикулоцитов СОЭ снижается, т.к. ретикулоцит имеет более отрицательный поверхностный заряд, чем эритроцит [48]. По видимому, в радиационном увеличении СОЭ основную роль играет снижение числа эритроцитов и изменение заряда их мембран.
Количество лейкоцитов в периферической крови уменьшается, независимо от типа излучения и его длительности [9,19,27,47,54], но в диапазоне доз 2,5-5 Р исследователи заметили увеличение количества лейкоцитов [33], обусловленное явлением гормезиса [20,61]. Наряду с уменьшением числа лейкоцитов в циркулирующей крови исследователи отмечают усиление лейкопоэза [54], что выражается в ускорении выхода лейкоцитов из костного мозга в кровь [36], увеличивается количество молодых клеток, в лейкоцитарной формуле наблюдается сдвиг влево [38,54]. Уменьшается осмотическая резистентность лейкоцитов [31]. Снижение числа лейкоцитов в периферической крови на фоне увеличения их продукции в костном мозге, по-видимому, связано с перераспределительными реакциями лейкоцитов, уменьшением их продолжительности жизни [36] и резким снижением числа нейтрофилов [14,16].
Наблюдаются дегенеративные изменения гранулоцитов: клетки приобретают неправильную форму, увеличиваются в размерах, наблюдается токсическая зернистость цитоплазмы, ее вакуолизация, фрагментация ядер [16,30]. Образование гигантских нейтрофилов идет за счет эндомитоза [15,18]. При достаточно высоких дозах (200 рад) наблюдается агранулоцитоз [9]. Отмечается абсолютное [14,59] и относительное [16,32,54] снижение числа нейтрофилов, связанное с гибелью их предшественников в костном мозге и малой продолжительностью их жизни [16].
Лимфоциты – наиболее радиочувствительные клетки иммунной системы. Из них наиболее чувствительны В-лимфоциты, они погибают уже при дозах облучения 1,2 - 1,8 Гр, для Т-лимфоцитов эта величина несколько выше – 2 - 2,5 Гр [60]. При облучении лимфоцитов в дозе 2 Гр в стадии интерфазы задержки продвижения клеток по клеточному циклу практически не наблюдалось. Клетки, облученные незадолго до реплекативного синтеза, отвечали длительной задержкой деления [51]. При тотальном облучении организма лимфоциты оказались немного менее устойчивыми (если считать, что 1Гр=100 Р): уже при 100 Р наблюдалась гибель клеток лимфоидной ткани [6]. В дозах, меньших 100 Р наблюдалось увеличение количества лимфоцитов в костном мозге, при этом их количество снижалось в селезенке и зобной железе [6]. Снижение числа лимфоцитов отмечалось в костном мозге при лучевой болезни [32,47], после интенсивной лучевой терапии [30]. Все вышесказанное, касающееся лимфоцитов, говорит об усилении их деления в дозах до 100 Р и резком снижении митотической активности при более высоких дозах.
Некоторые исследователи указывают на наличие лейкопоэтинов в плазме крови и их непосредственного участия в патологических процессах. В дозах до 450 Р активность лейкопоэтинов увеличивается с увеличением дозы и степени лейкопении [1,44]. При дозах больших 450 Р исчезает лейкопоэтическая активность плазмы и появляются вещества, тормозящие лейкопоэз. Затем, когда доза превышает 600 Р, содержание лейкопоэтинов снова увеличивается [44].
Эозинофилы, как и нейтрофилы, под влиянием излучения обнаруживают способность к ускоренной дифференциации [15]. Убыль абсолютного их числа в крови, очевидно, можно объяснить снижением их продолжительности жизни в кровяном русле. Снижается количество моноцитов в периферической крови [14].
Изучено изменение содержания тромбоцитов. Большинство исследователей отмечают снижение их количества в ближайшие и отдаленные периоды воздействия, при хронических и однократных облучениях [9,19,27]. В ближайшие 2 месяца после облучения количество тромбоцитов сначала падает, затем повышается и достигает стабильной величины на 35-52 сутки, не достигая первоначального уровня [22].
В отдаленные сроки после лучевого воздействия в крови отмечаются следующие изменения: гипертрофия костного мозга, увеличение в нем доли молодых форм, ускорение дифференциации клеток, увеличение выработки маложизнеспособных клеток [50,58], усиление эритропоэза [3], снижение продолжительности жизни эритроцитов [3,41,50], снижение их количества в периферичесчкой крови [3,7,24,50]. У ликвидаторов на 3-м году после облучения наблюдается снижение содержания в крови эритроцитов и гемоглобина, увеличение объема эритроцитов [26], их полихроматофилию [7]. Некоторые исследователи не отмечают снижения концентрации гемоглобина [24]. Отмечается снижение числа ретикулоцитов [7]. У жителей загрязненных территорий наблюдается увеличение СОЭ [2]. Наблюдается снижение количества лейкоцитов [24,26,50,58]. Не наблюдается изменения числа лейкоцитов в отдаленном периоде после повторного облучения [7]. Через 5-8 лет после облучения наблюдается увеличение числа лейкоцитов и моноцитов [41]. На 3-м году после облучения у ликвидаторов увеличивается количество нейтрофилов [7,26]. Отмечается снижение числа лимфоцитов и тромбоцитов [7,24]. Снижение числа форменных элементов крови в отдаленный период воздействия можно объяснить снижением компенсаторных возможностей системы кроветворения, которой приходится вырабатывать больше клеток, компенсируя тем самым их низкую жизнеспособность.
1.3. Возрастные изменения в организме.
Как уже было отмечено, воздействие радиации приводит к ускорению старения организма. В основе старения лежат изменения ДНК клеток, накопленные с возрастом в результате мутагенного действия факторов среды и химических агентов, образующихся в результате жизнедеятельности клетки (О 2 , ОН*, Н 2 О 2 и др.). Эти вещества вызывают повреждения других клеточных структур (например, переокисление липидов мембран), в том числе и систему репарации клетки. В результате снижается ее эффективность и она сама может вызывать повреждения ДНК. Т.о., в процессе старения образуются такие же химические агенты и происходят сходные процессы в клетке, как и в результате радиоактивного воздействия, поэтому его смело можно считать одним из факторов процесса старения.
С возрастом в клетке увеличивается количество повреждений митохондрий, уменьшается количество АТФ, снижается скорость синтеза и самообновления фосфолипидов, снижается концентрация рецепторов нейромедиаторов и гормонов, замедляется деление клеток [11]. В общем можно говорить о снижении жизнедеятельности клеток.
Организм человека примерно до 50 лет характеризуется относительно постоянным составом внутренней среды, затем начинаются нарушения гомеостаза.
С возрастом снижается количество эритроцитов, устанавливаясь к 80-90 годам на нижней границе нормы, падает число ретикулоцитов, нарастает диаметр эритроцитов и амплитуда анизоцитоза [57]. Эти изменения объясняются уменьшением массы кроветворящего красного костного мозга, составляющая у 80-летнего 1/20 часть красного костного мозга 20-летнего [57]. Снижается скорость разрушения крови, связанная с возрастной инволюцией селезенки. Концентрация гемоглобина у лиц пожилого и старческого возраста находится в пределах нижней границы нормы, выведенной для зрелого возраста [13].
С возрастом падает концентрация альбуминов и повышается концентрация глобулинов, что связано с изменением белок-синтезирующей функцией печени и большей проницаемостью стенок капилляров для альбуминов, чем для глобулинов [13].
СОЭ имеет тенденцию к повышению между 40-49 годами, когда ее величина лишь в 79% случаев ниже 10 мм/ч. Затем она постепенно увеличивается, после 60 лет величина СОЭ ниже 10 мм/ч выявляется у 12,5% людей [49]. Снижение СОЭ можно объяснить снижением количества и потерей электрического потенциала эритроцитов, повышением концентрации глобулинов.
Количество лейкоцитов в возрасте 90 лет составляет около 4 тыс./мкл. В глубокой старости количество лимфоцитов понижается на 24% [25].
Количество тромбоцитов к старости также уменьшается [13].
2. МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Предметом анализа послужили результаты обследования 400 мужчин в возрасте от 33 до 62 лет, подвергшихся радиоактивному облучению в дозах до 80 бэр во время ликвидации последствий аварии на Чернобыльской АЭС. Использовались данные, полученные за весь промежуток времени, прошедший с момента аварии.
Изучались следующие показатели периферической крови: количество эритроцитов, лейкоцитов и тромбоцитов, содержание гемоглобина, параметры лейкоцитарной формулы, скорость оседания эритроцитов (СОЭ).
Контрольную группу составили 300 человек, не имевших контакта с ионизирующим излучением.
Определяли количество эритроцитов, концентрацию гемоглобина, СОЭ, количество тромбоцитов, лейкоцитов и лейкоцитарную формулу.
Количество эритроцитов определялось фотоэлектроколориметрическим методом, концентрация гемоглобина – гемиглобинцианидным методом, СОЭ – по Панченкову, количество лейкоцитов – в счетной камере Горяева, параметры лейкоцитарной формулы и количество тромбоцитов определялись в мазке, окрашиваемом по Романовскому-Гимзе в течении 40 мин.
Динамика показателей изучалась следующим образом. Для каждого ликвидатора время, прошедшее с окончания воздействия облучения, делилось на двухгодичные интервалы. В зависимости от того, сколько времени прошло от момента окончания действия излучения до данного обследования, данные относились к 1-му интервалу (1-2 года после облучения), 2-му (3-4), 3-му (5-6), 4-му (7-8), 5-му (9-10) или 6-му интервалу (11-12 лет после облучения). По каждому интервалу вычислялись средние арифметические и ошибки средних с целью последующего сравнения со значениями условной нормы с помощью адекватных параметрических критериев согласия.
В массиве обследованных было выделено 3 возрастные группы: 1-ю составляли ликвидаторы в возрасте от 33 до 42 лет (180 человек), 2-я – 43-52 года (185 человек), 3-я – 53-62 года (35 человек). Для каждой возрастной группы было выделено три четырехгодичных интервала: 1-4 года после облучения, 5-8 лет и 9-12 лет. Для каждого временного интервала вычислялись средние арифметические и ошибки средних. Полученные данные сравнивались с соответствующим возрастным контролем.
Все вычисления производились в компьютерном приложении Microsoft Excel 97.
3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты обработки экспериментального первичного материала представлены в таблицах 3.1.-3.3. и на рисунках 3.1.-3.7.
3.1. Изменения параметров крови в зависимости от возраста.
Анализ постэкспозиционной динамики изучаемых показателей с учетом возраста позволил установить следующие закономерности.
Статистически значимое снижение числа эритроцитов установлено лишь для 1-й возрастной группы (33-42 года), причем, наибольшее понижение (до 4,60± 0,038 млн./мкл) отмечено на 1-4-м году последействия (табл. 3.1., рис. 3.1.). В двух других возрастных группах изменения показателя были разнонаправленными и статистически незначимыми.
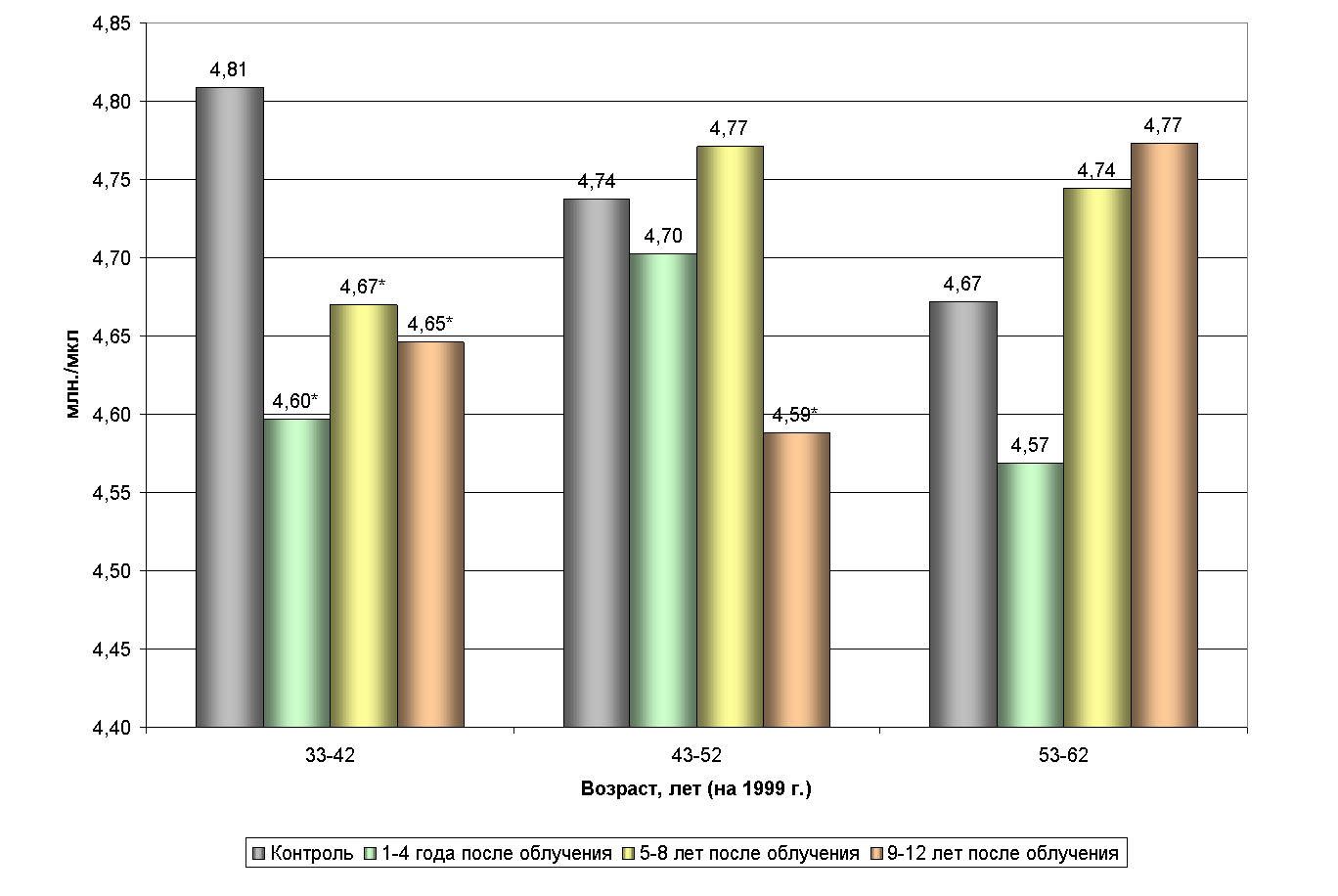
Рис. 3.1. Постэкспозиционное изменение количества эритроцитов в зависимости от возраста.
* - статистически значимые отличия от нормы
Изменения содержания гемоглобина повторяют в целом динамику количества эритроцитов, что обусловлено тесной связью этих показателей. В 1-й возрастной группе на 1-4-м году после облучения концентрация гемоглобина значимо снижается (до 141,6± 1,26 г/л при
 условной возрастной норме 147,4± 1,05) (табл. 3.1., рис. 3.2.). В двух других возрастных группах достоверного уменьшения концентрации гемоглобина не отмечено.
условной возрастной норме 147,4± 1,05) (табл. 3.1., рис. 3.2.). В двух других возрастных группах достоверного уменьшения концентрации гемоглобина не отмечено.
Можно предположить, что постэкспозиционное уменьшение числа эритроцитов и содержания гемоглобина в первой возрастной группе связано с низкой устойчивостью молодо
Рис. 3.2. Постэкспозиционное изменение концентрации
гемоглобина в зависимости от возраста.
го организма (возраст значительной доли обследованных 1-й группы составил на момент облучения 20-22 года) к повреждающим факторам окружающей среды, в том числе и к радиации.
Скорость оседания эритроцитов повышается во всех возрастных группах (табл. 3.1., рис. 3.3.), что обусловлено, вероятно, уменьшением количества эритроцитов и изменениями физико-химических свойств плазмы крови в постэкспозиционном периоде [2,8]. Наибольший прирост наблюдается на 1-4-м году постэкспозиции, достигая 6,8± 1,24 мм/ч в старшей возрастной группе (53-62 года). На последующих этапах СОЭ несколько снижается, причем, заметна обратная зависимость эффективности процесса восстановления от возраста. Можно предположить, что восстановительные процессы в старших возрастных группах отчасти компенсируют встречное повышение СОЭ, обусловленное чисто возрастным фактором.
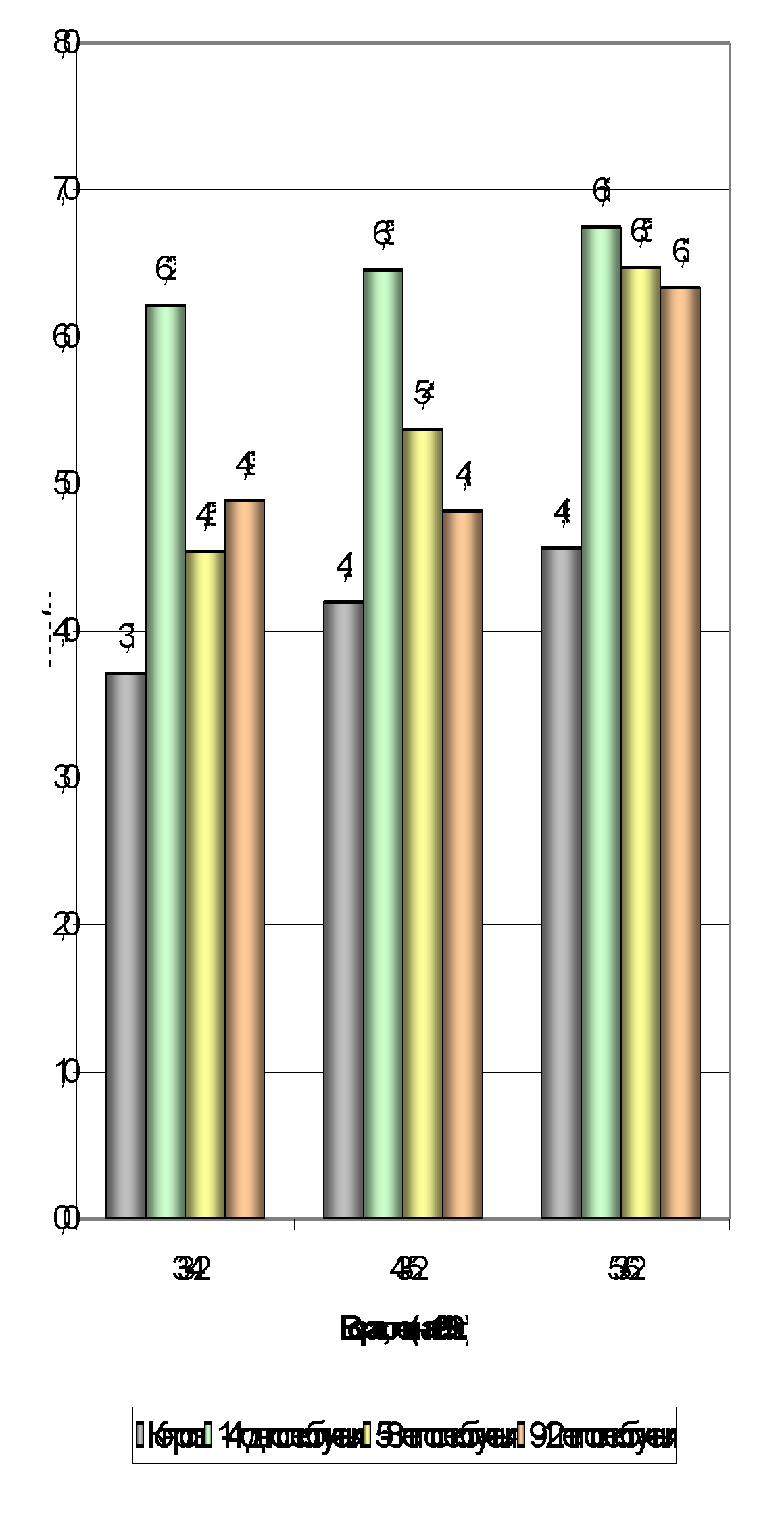
Рис. 3.3. Постэкспозиционное изменение СОЭ в зависимости от возраста.
Относительно числа лейкоцитов и параметров лейкоцитарной формулы не выявлено значимых возрастных различий в постэкспозиционной динамике в силу значительной вариабельности этих показателей. Наблюдаемые возрастные различия указанных параметров не проявляют видимой закономерности, не поддаются трактовке и обусловлены, вероятно, рядом неучтенных влияний.
3.2. Динамика показателей периферической крови.
Обобщенный анализ динамики изучаемых показателей по всему массиву обследованных (без учета возраста) позволил отметить следующие факты.
При анализе постэкспозиционной динамики содержания эритроцитов было выявлено первоначальное его снижение на 1-2-м году после облучения (с 4,74±0,016 до 4,58±0,045 млн./мкл) (табл. 3.2., рис. 3.4.). Уменьшение количества эритроцитов в ближайшем постэкспозиционном периоде отмечено многими исследователями [27,37,43,56 и др.] и закономерно
объясняется гибелью предшественников эритроцитов в костном мозге и снижением продолжительности жизни циркулирующих эритроцитов [37,56,58].
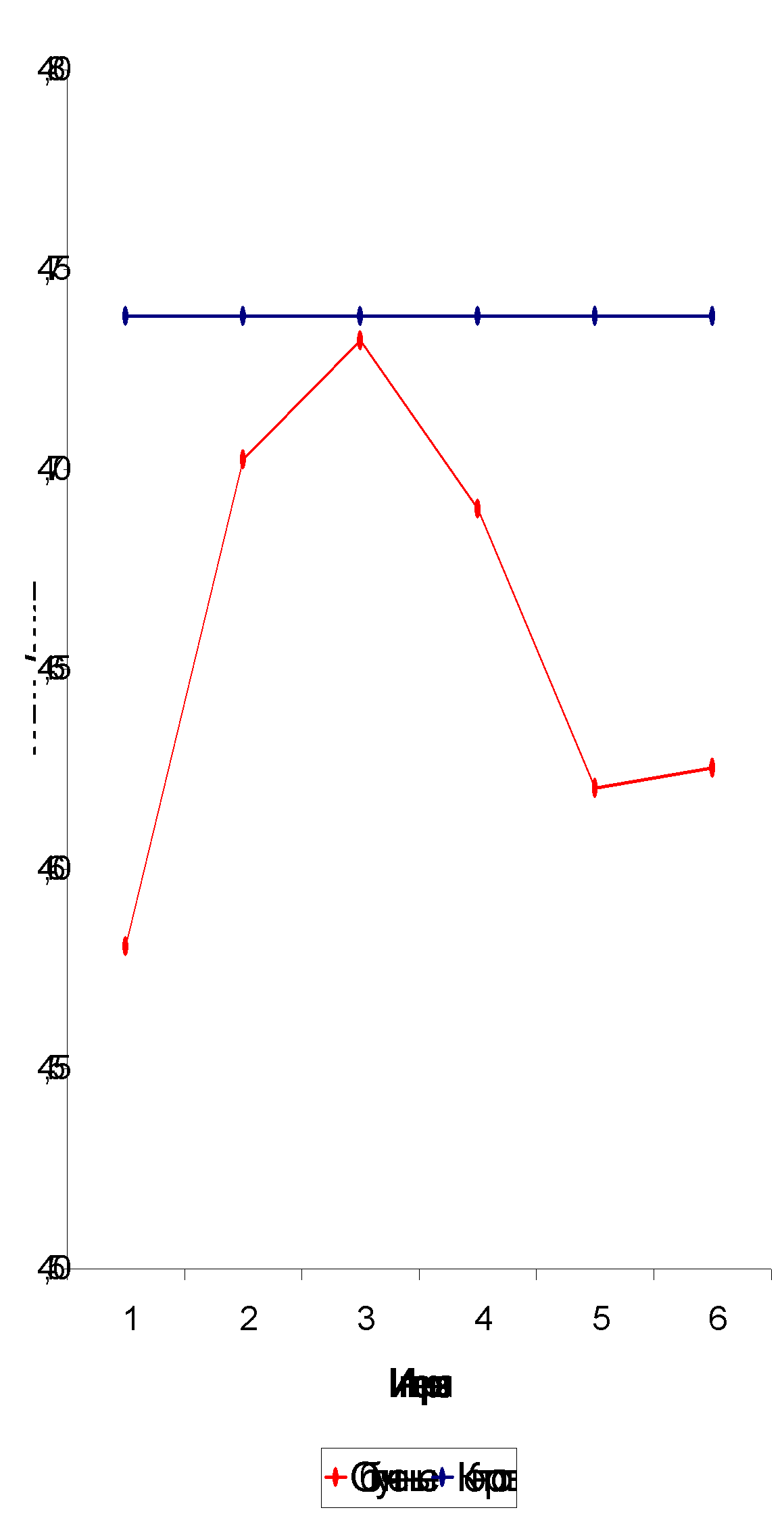
Рис. 3.4. Динамика эритроцитов.
К 3-му году после облучения количество эритроцитов возрастает до величины, близкой к норме (4,73±0,027 млн./мкл), что может свидетельствовать о восстановлении эритроидного ростка костного мозга. Как отмечают некоторые авторы, восстановление это кажущееся, оно сопровождается гиперплазией костного мозга, ускорением дифференциации эритроцитов [50,58], что снижает эффективность эритропоэза, приводя к продукции клеток с низкой жизнеспособностью и укороченным сроком жизни [3,37,50]. С 6-8-го года наблюдается монотонное уменьшение числа эритроцитов, что свидетельствует о второй волне истощения костного мозга в отдаленные сроки в результате, как можно предположить, преждевременного старения организма.
Концентрация гемоглобина уменьшается на 1-2-м году после окончания облучения, что согласуется с литературными данными [37,53] и является закономерным следствием снижения количества эритроцитов (табл. 3.2., рис. 3.5.). На 3-4-м году концентрация гемоглобина возрастает до величины, близкой к норме (143,0±0,97 г/л) и остается практически неизменной до конца периода обследования. Аналогичная динамика отмечена в работе Э.К.Джикидзе и Л.П.Косиченко, наблюдавших восстановление содержания гемоглобина у высших обезьян на 2-м году после облучения [21]. Последующего снижения количества гемоглобина как проявления раннего старения организма не отмечено; по-видимому, оно наблюдается в более поздние сроки, выходящие за временные рамки нашего исследования.
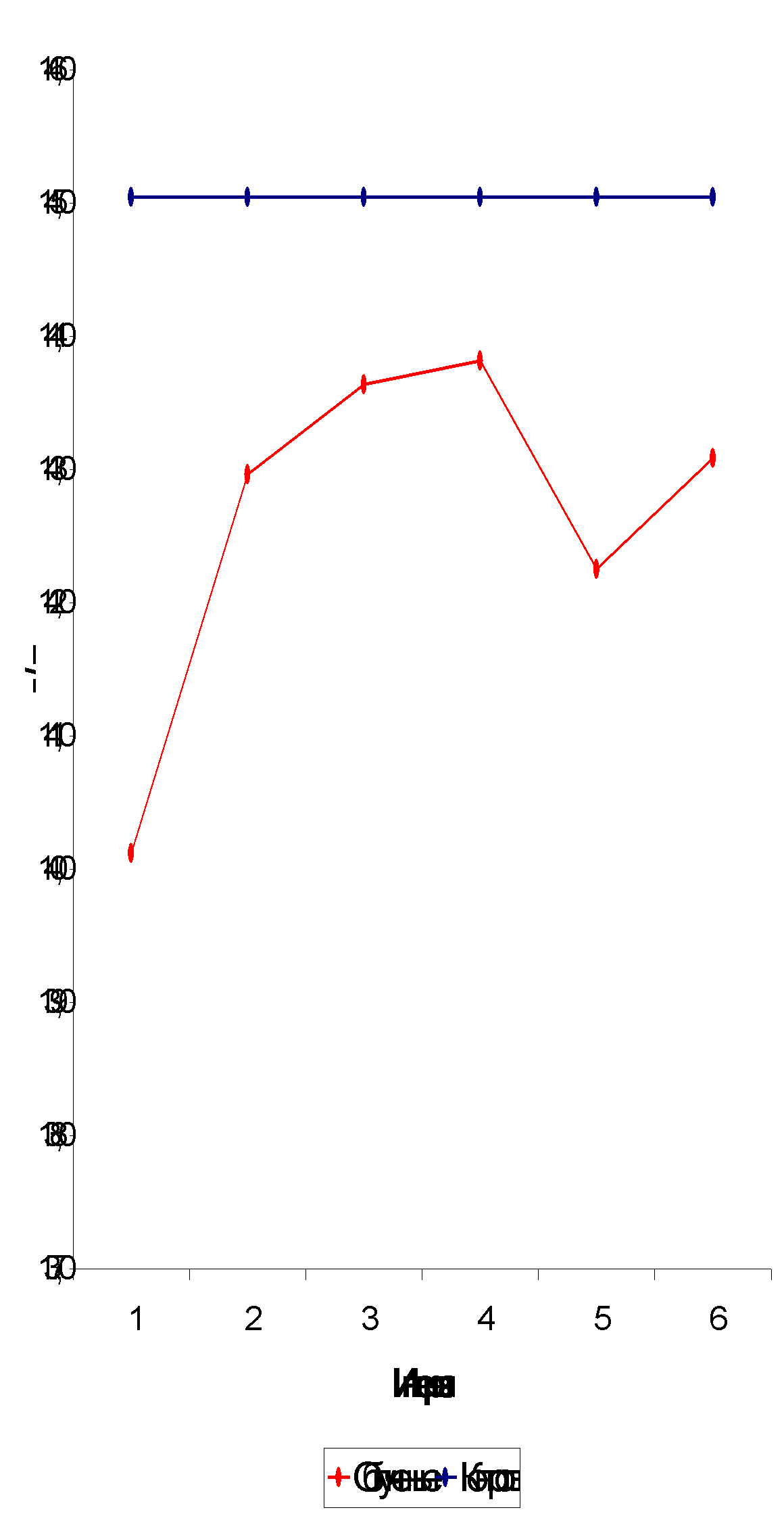
Рис. 3.5. Динамика гемоглобина.
Скорость оседания эритроцитов на 1-2-м году после облучения существенно превышало уровень нормы (табл. 3.2., рис. 3.6.), в последующие периоды величина этого показателя снижалась и к 7-8-му году достоверно не отличалась от контрольного значения. На 11-12-м году СОЭ несколько увеличивается, что может служить индикатором преждевременного старения организма как одного из последствий облучения.
Количество лейкоцитов на 1-2-м году (7,00±0,277 тыс./мкл) статистически значимо превышает нормальный уровень (6,00±0,067 тыс./мкл), на 3-4-м году оно уменьшается до 5,87±0,178 тыс./мкл, оставаясь сравнительно стабильным в последующие периоды.
Количество тромбоцитов на 1-2-м году постэкспозиционного периода достоверно ниже нормальной величины (табл. 3.2., рис. 3.7.), что согласуется с данными других исследователей [14,19,27]. В дальнейшем уровень показателя повышается и на 3-6-м году после облучения практически не отличается от контрольного. Такое повышение носит, скорее всего, компенсаторный характер. На 7-м году после облучения содержание тромбоцитов снова снижается, что может свидетельствовать об истощении механизма компенсации и наступле
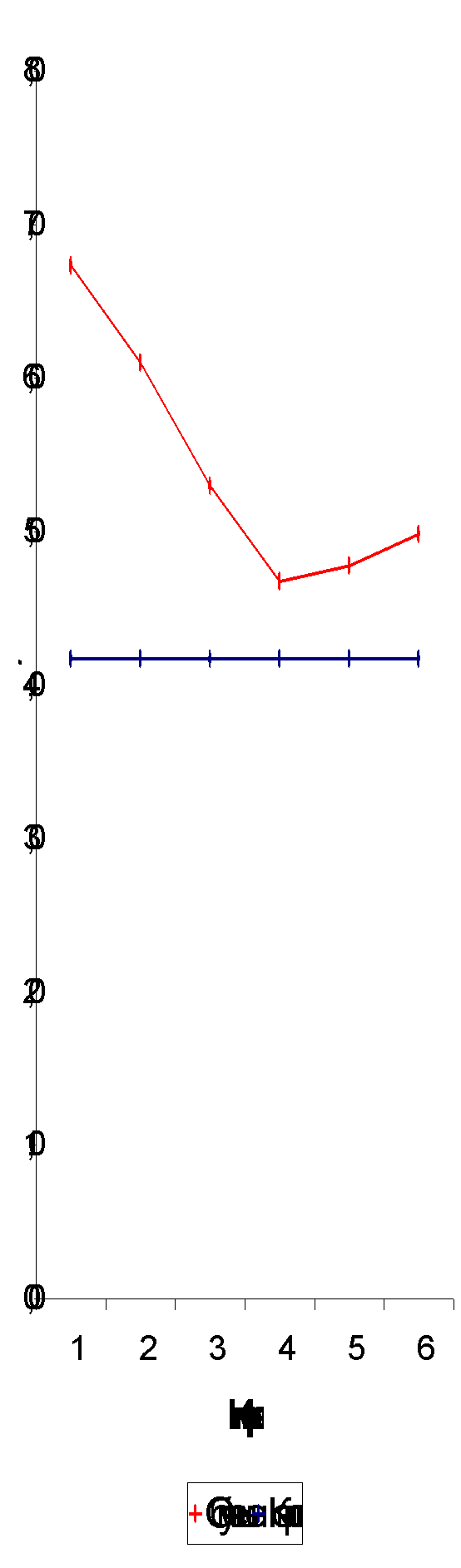
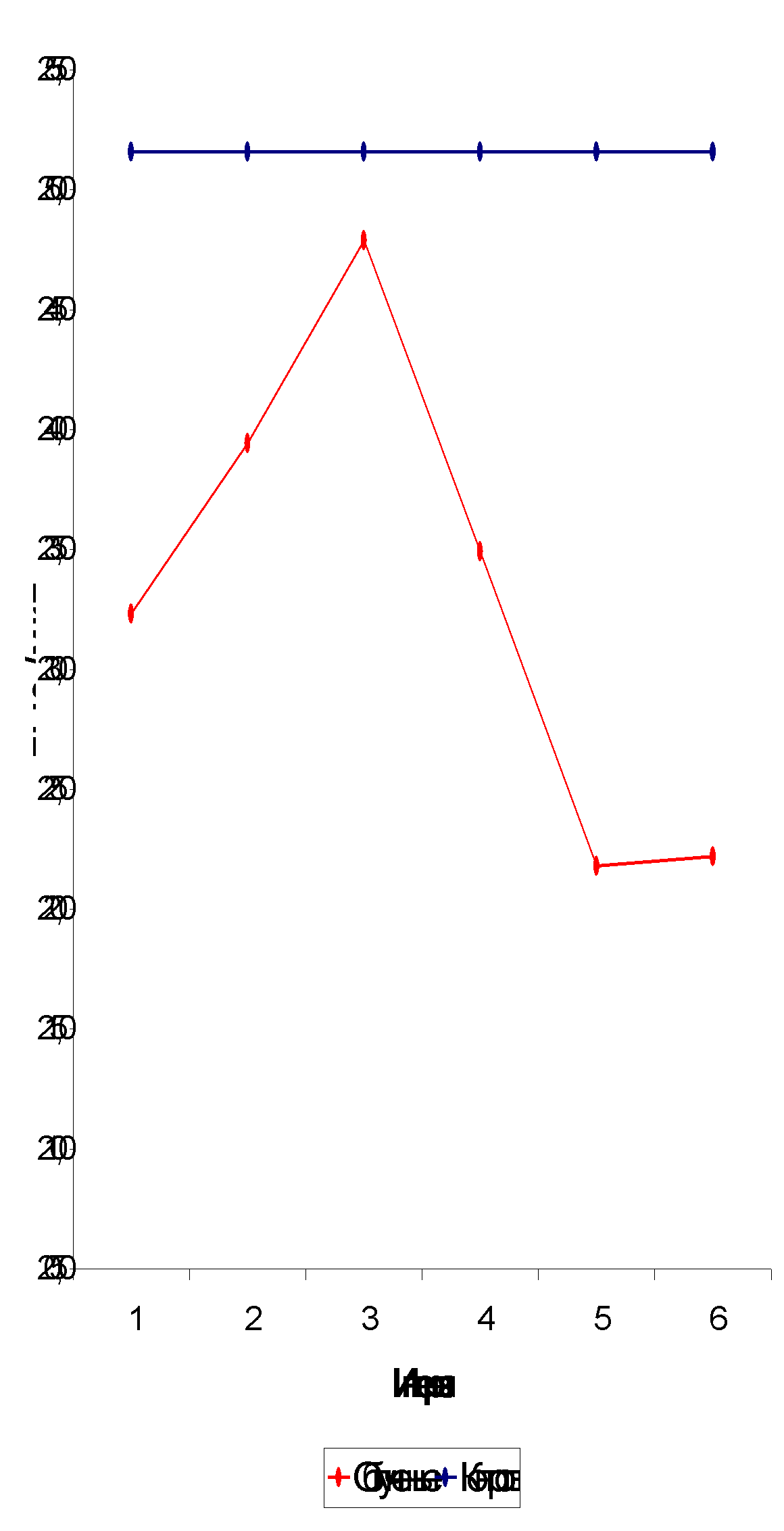 Рис. 3.6. Динамика СОЭ.
Рис. 3.6. Динамика СОЭ.
Рис. 3.7. Динамика тромбоцитов.
нии второй волны истощения костного мозга. Снижения количества тромбоцитов в отдаленный период после облучения отмечено рядом исследователей [7,24].
Описанная выше динамика показателей периферической крови дает основание предполагать наличие второй волны угнетения костного мозга, связанное с истощением механизма компенсации. Поскольку угнетение функции костного мозга характерно для старческого возраста, снижение количества тромбоцитов может рассматриваться в качестве одного из первых признаков преждевременного старения организма. Повышение скорости старения у ликвидаторов отмечено в литературе [5].
3.3. Изменения состава крови в зависимости от дозы.
С целью выяснения зависимости показателей крови от дозы испытуемые были разбиты на три группы в соответствии с полученной дозой облучения: менее 2 бэр, 2-10 бэр и более 10 бэр. Ни по одному из изучаемых показателей не выявлено зависимости от дозы облучения (табл. 3.3.), хотя в литературе имеются данные об улучшении состояния организма при дозах, меньших 2 сГр (приблизительно 2 бэра) [42]. Мнения различных исследователей по данному вопросу носят противоречивый характер: одни авторы находят зависимость степени поражения от дозы [6,9,44], другие не находят [24]. В нашем случае отсутствии корреляции доза-эффект можно объяснить ограниченностью контингента ликвидаторов, для которых установлена доза внешнего излучения и недостаточной адекватностью оценок значений этих доз.
Таблица 3.3.
Изменение некоторых показателей крови у ликвидаторов в зависимости от дозы (х± m).
|
|
Количество эритроцитов, млн./мкл |
Концентрация гемоглобина, г/л |
СОЭ, мм/ч |
Количество лейкоцитов, тыс./мкл |
Количество тромбоцитов, тыс./мкл |
||||||||||
|
до 2 бэр |
4,63 |
± |
0,097 |
140,1 |
± |
2,18 |
5,1 |
± |
0,65 |
6,38 |
± |
0,560 |
231,6 |
± |
8,54 |
|
2-10 бэр |
4,66 |
± |
0,037 |
143,8 |
± |
1,06 |
5,5 |
± |
0,34 |
6,01 |
± |
0,167 |
233,3 |
± |
4,73 |
|
более 10 бэр |
4,75 |
± |
0,047 |
142,9 |
± |
1,67 |
6,4 |
± |
0,72 |
6,09 |
± |
0,266 |
236,9 |
± |
7,19 |
|
Контроль |
4,74 |
± |
0,016 |
145,0 |
± |
0,53 |
4,2 |
± |
0,13 |
6,00 |
± |
0,067 |
251,6 |
± |
3,78 |
ВЫВОДЫ
У ликвидаторов последствий аварии на Чернобыльской АЭС на начальном периоде постэкспозиции наблюдаются следующие изменения картины крови: снижение количества эритроцитов и тромбоцитов, уменьшение содержания гемоглобина, повышение СОЭ.
Динамика показателей периферической крови ликвидаторов характеризуется начальной стадией восстановления (фаза компенсации), сменяющейся на 7-8 году после облучения стадией регресса (фаза истощения компенсаторных возможностей).
Наибольшие изменения картины крови наблюдаются в младшей возрастной группе, что свидетельствует о меньшей устойчивости молодого организма к воздействию ионизирующих излучений.
У ликвидаторов, подвергшихся действию малых доз ионизирующего излучения, не установлено зависимости изменений картины крови от величины дозы.
ЛИТЕРАТУРА
1. Абакелия Ц.И., Цомая И.С., Одишвили М.Г. К вопросу о наличии лейкопоэтически активных веществ при лейкопениях, вызванных воздействием ионизирующей радиации // Тез. VI Всесоюз. науч. конф. “Восстановительные и компенсаторные процессы при лучевых поражениях”.-Л., 1973.-С.60-61.
2. Абдулкодыров К.М., Самускевич И.Г., Грицаев С.В. Результаты гематологического обследования населения, проживающего в зоне усиленного радиационного контроля Брянской области // Врачебное дело.-1998.-№2.-С.24-27.
3. Акоев И.Г. Отдаленные последствия облучения в системе крови // Мед. радиол.-1968.-Т.13.-№1.-С.21-27.
4. Антонов В.П. Уроки чернобыля: радиация, жизнь, здоровье.-К.:Знание, 1989.-112 с.
5. Ахаладзе М.Г. Биологический возраст и авария на Чернобыльской АЭС // Журн. АМН Украины.-1997.-№4.-С.672-680.
6. Белоусова О.И., Федотова М.И. Количественная оценка ранней реакции лимфоидной ткани на облучение в широком диапазоне доз // Вопросы радиобиологии.-Томск, 1968.-С.29-35.
7. Богатов Л.В. Особенности костномозгового кроветворения в поздние сроки после вторичного острого облучения // Отдаленные последствия лучевых поражений.-М.:Атомиздат, 1971.-С.99-106.
8. Богданова-Березовская И.Г. Реакция периферической крови черепахи на облучение в условиях in vitro // Тр. мол. учен.-медиков Узбекистана.- Ташкент.-1975. Т.6, ч.2.-С.272-273.
9. Бриллиант М.Д., Воробьев А.И. Изменение некоторых показателей периферической крови при тотальном облучении человека // Проблемы гематологии и переливания крови.-1972.-№1.-С.7-11.
10. Бычковская И.Б. Защитное действие гипоксии при кратковременном и длительном облучении мышей гамма-лучами // Мед. радиол.-1961.-№6.-С.68-73.
11. Виленчик М.М. Биологические основы старения и долголетия.-2-е изд., перераб. и доп.- М.:Знание, 1987.-224 с.
12. Власов П.А. Морфологическая картина изменений органов кроветворения в отдаленном периоде хронической лучевой болезни, вызванной Sr-90 // Вопросы радиобиологии.-Томск, 1968.-С.86-88.
13. Возрастная физиология. В серии: Руководство по физиологии. Л.:Наука, 1975.-692 с.
14. Гольдберг Е.Д. Оценка сдвигов показателей крови при хроническом профессиональном облучении рентгенологов // Мед. радиол.-1966.- №8.-С.53-55.
15. Гольдберг Е.Д., Воробьева М.Г. Костномозговое кроветворение при острейшей форме лучевой болезни, вызванной облучением на сильноточном бетатроне 25 МэВ // Вопросы радиобиол. и биол. действия цитостатических препаратов.-Томск, 1970.-Т.2.-С.5-12.
16. Гольдберг Е.Д., Голосов О.С., Потехин К.Г. Гематологические показатели у работников рентгенологических и радиологических отделений // Мед. радиол.-1961.-№5.- С.49-54.
17. Гольдберг Е.Д., Краснова Т.А. Тетерина В.И. Состояние пролиферативной активности и скорость дифференцировки кроветворных клеток в ранние сроки острой лучевой болезни // Вопросы радиобиол. и биол. действия цитостатических препаратов.-Томск, 1978.-Т.9, С.120-123.
18. Гольдберг Е.Д., Лапина Г.Н., Карпова Г.В. Новые данные к механизму образования гигантских нейтрофильных лейкоцитов при острой лучевой болезни // Вопросы радиобиол. и биол. действия цитостатических препаратов.-Томск, 1971.-Т.3.-С.43-46.
19. Грибова И.А., Солдатова В.А. Состояние крови у лиц, перенесших хроническую лучевую болезнь // Тез. VI Всесоюз. науч. конф. “Восстановительные и компенсаторные процессы при лучевых поражениях”.-Л., 1973.-С.64.
20. Гусаров И.И., Дубовской А.В. Радонотерапия и радиационный гормезис // Мед. радиол. и радиац. безопасность.-1999.-№2.-С.18-25.
21. Джикидзе Э.К., Косиченко Л.П. Гематологические и цитогенетические изменения в отдаленные сроки после повторного облучения обезьян // Тез. VI Всесоюз. науч. конф. “Восстановительные и компенсаторные процессы при лучевых поражениях”.-Л., 1973.-С.70.
22. Диковенко Е.А. Состояние эритропоэза и биосинтез гемоглобина при радиационном поражении // Вопросы радиобиологии.-Томск, 1968.-С.65-71.
23. Домрачева Е.В., Ривкинд Н.Е., Шкловский-Корди Н.Е. Мультиаберрантные клетки у жителей территории, загрязненной радионуклидами в результате аварии на Чернобыльской АЭС и участников ликвидации этой аварии // Проблемы гематологии и переливания крови.-1997.-№2.-С.12-19.
24. Евсеева Н.К. Кроветворение у собак в течение четырех лет после гамма-нейтронного облучения. // в кн. Отдаленные последствия лучевых поражений.-М.:Атомиздат, 1971.-С.107-113.
25. Ефимов В.В. Возрастная физиология.- М., 1948.-247 с.
26. Жиляев Е.Г., Ушаков И.Б., Солдатов С.К. Ближайшие и отдаленные нестохастические гематологические последствия при воздействии малых доз ионизирующих излучений: Обзор // Воен.-мед. журн.-1992.-№11.-С.44-47.
27. Запольская Н.А., Борисова В.В., Жорно Л.Я. Количественная оценка восстановительных реакций в крови после однократного и хронического гамма-облучения // Тез. VI Всесоюз. науч. конф. “Восстановительные и компенсаторные процессы при лучевых поражениях”.-Л., 1973.-С.69.
28. Каландорова М.П., Невская Г.Ф. К вопросу о механизме компенсации нарушенных функций в кроветворной системе у собак при однократном и повторном облучениях протонами высокой энергии в условиях локальной защиты тела // Вопросы радиобиол. и биол. действия цитостатических препаратов.-Томск, 1971.-Т.3.- С.61-64.
29. Капанак Л.К., Арутюнян Р.А. Изменение эритропоэтической активности крови животных под действием общего однократного и хронического рентгеновского облучения // Тез. VI Всесоюз. науч. конф. “Восстановительные и компенсаторные процессы при лучевых поражениях”.-Л., 1973.-С.59-60.
30. Карибская Е.В., Матецкая Т.Э. Об изменениях в перииферической крови при лучевой терапии // Мед. радиол.-1962.-№11.-С.39-45.
31. Карибская Е.В., Нечаева Т.И. Солевая хрупкость лейкоцитов крови при воздействии проникающего излучения // Вопросы лучевой терапии (Тр. гос. н.-и. рентгенологического ин-та).-М.,1964.-Т.XI, кн. 1.-С.5-11.
32. Карпова Г.В. О течении восстановительных процессов в костном мозге животных при тотальном и неполном их облучении большими дозами ионизирующей радиации // Вопросы радиобиол. и биол. действия цитостатических препаратов.-Томск, 1971.-Т.3.-С.65-70.
33. Кейзер С.А., Молчанов М.Г. Изменение гемопоэза у белых крыс при однократном и хроническом воздействии гамма-лучей // Вопросы радиобиологии.-Томск, 1968.-С.78-85.
34. Коггл Дж. Биологические эффекты радиации: Пер. с англ.-М.: Энергоатомиздат.-1986.-184 с.
35. Козинец Г.И., Жиляев Е.Г. Клетки периферической крови ликвидаторов аварии на Чернобыльской АЭС после пятилетнего наблюдения // Гематология и трансфузиология.-1993.-№9.-С.35-38.
36. Козинец Г.И., Цессарская Г.П., Богоявленская М.П. Изучение пролиферативной способности кроветворных клеток с помощью радиоактивных индикаторов при лучевой терапии // Мед. радиол.-1962.-№7.-С.50-57.
37. Колмогорова Л.А. Состояние эритрона в условиях длительного фракционированного облучения // Вопросы радиобиологии и биологического действия цитостатических препаратов / Под ред. проф. Е.Д. Гольдберга.-Томск, 1976.-Т.7.-С.127-132.
38. Кузнецова Н.Е., Лоскутова З.Ф., Молоков И.Н. Восстановление гематологических показателей собак при длительном фракционированном облучении // Тез. VI Всесоюз. науч. конф. “Восстановительные и компенсаторные процессы при лучевых поражениях”.-Л., 1973.-С.65.
39. Куликов И.В., Молчанова И.В., Караваева Е.Н. Радиоэкология почв и растительных покровов. - Свердловск: АН СССР, 1990. - с.187.
40. Левина А.А., Цибульская М.М. Изменения в метаболизме железа под действием ионизирующей радиации // Гематология и трансфузиология.-1993.-№9.-С.5-8.
41. Лыков А.П., Сахно Л.В., Михеенко Т.В. Гемопоэз у ликвидаторов аварии на Чернобыльской АЭС // Гематология и трансфузиология.-1998.-№2.-С.34-36.
42. Лютых В.П., Долгих А.П. Клинические аспекты действия малых доз ионизирующих излучений на человека // Мед. радиол. и радиац. безопасность.-1998.-№2.-С.28-34.
43. Маленкова К.М. Изменения некоторых биохимических показателей крови при воздействии рентгеновских лучей // Вестник рентгенол. и радиол.-М.,-1958.-№3.-С.74.
44. Маркосян В.С., Синонян Н.О, Арутюнян Р.А. Изучение изменений лейкопоэтической активности крови животных, подвергнутых воздействию ионизирующего излучения // Тез. VI Всесоюз. науч. конф. “Восстановительные и компенсаторные процессы при лучевых поражениях”.-Л., 1973.-С.58-59.
45. Муксинова К.Н. Значение характера дифференцировки стволовых клеток в нарушении кроветворения при длительном радиационном воздействии // Тез. VI Всесоюз. науч. конф. “Восстановительные и компенсаторные процессы при лучевых поражениях”.-Л., 1973.-С.65-66.
46. Невская Г.Ф., Абрамова Г.М., Гинсбург Е.В. Зависимость лучевого поражения организма от функциональной активности экранированного участка костного мозга // Вопросы радиобиол. и биол. действия цитостатических препаратов.-Томск, 1971.-Т.3.-С.56-60.
47. Нековалева Н.А. Отдаленные результаты изменения гемопоэза при лучевой болезни и аутотрансплантации костного мозга // Тез. VI Всесоюз. науч. конф. “Восстановительные и компенсаторные процессы при лучевых поражениях”.-Л., 1973.-С.45-46.
48. Оседание эритроцитов // БМЭ.-3-е изд.-М.,-1981.-Т.17.-с.442-443.
49. Пархон К.И. Возрастная биология.- Бухарест, 1959.-471 с.
50. Перминова О.А. Состояние эритрона у крыс в отдаленные сроки после общей лучевой травмы // Радиобиология.-1985.-№4.-С.539-544.
51. Порядкова Н.А. Изучение клеточного цикла лимфоцитов человека, облученных на разных стадиях с помощью дифференциальной окраски сестринских хроматид // Механизмы лучевой патологии / Под ред. Ю.Б.Кудряшова.-М.:Изд-во Моск. ун-та, 1984.-С.133.
52. Радиация: дозы, эффекты, риск : Пер. с англ.-М.:Мир, 1988.-79 с.: ил.
53. Руководство по радиационной гематологии: Пер. с англ.- М.:Медицина, 1974.-328 с.
54. Соколов В.В., Грибова И.А. Морфологическая и функциональная характеристика лейкопоэза при лейкопении радиационной этиологии // Вопросы радиобиологии.-Томск, 1968.-С.93-98.
55. Стародуб Н.Ф., Рекун Г.М.,Шурьян И.М. Радиационное поражение гемоглобина.-К.:Наукова думка, 1976.-130 с.
56. Тяжелова В.Г. Принципы и численные параметры регулирования постоянства состава эритроцитов при пострадиационном восстановлении // Механизмы лучевой патологии / Под ред. Ю.Б.Кудряшова.-М.:Изд-во Моск. ун-та, 1984.-С.92-103.
57. Физиология системы крови. В серии: Руководство по физиологии. Л.: Наука, 1968. - 280 с.
58. Шмелева Н.И. Особенности эритропоэза у животных, перенесших острую лучевую болезнь // Радиобиология.-1972.-№4.-С.427-437.
59. Щербакова Е.Н. Поражение и восстановление системы крови при острой лучевой патологии // Механизмы лучевой патологии / Под ред. Ю.Б.Кудряшова.-М.: Изд-во Моск. ун-та, 1984.-С.62-70.
60. Ярилин А.А. Действие ионизирующей радиации на лимфоциты (повреждающий и активирующий эффекты) // Имунология.-№5.-С.5-11.
61. Ярмоненко С.П. Кризис радиобиологии и ее перспективы, связанные с изучением гормезиса // Мед. радиол. и радиац. безопасность.-1997.-№2.-С.5-10.
62. Ярмоненко С.П. Радиобиология человека и животных.- М.: Высш.шк.-1988.-375 с.